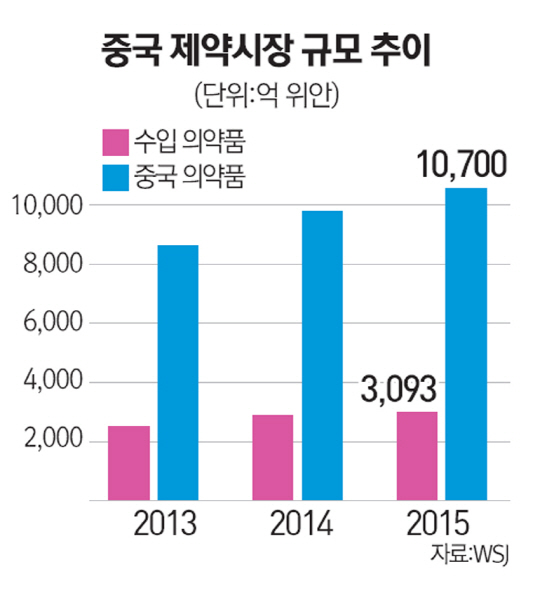
선진국 임상시험의 문턱을 넘지 못한 의약품들이 중국에서 새 활로를 찾고 있다고 29일(현지시간) 월스트리트저널(WSJ)이 보도했다. 글로벌 제약사들이 상대적으로 쉽게 신약 승인을 받을 수 있는 중국 제약사에 기술수출 방식으로 의약품을 우회 판매하고 있다는 분석이다.
미국 제약사 브리스톨마이어스큅은 지난 2013년 자사가 개발한 간암 치료제 ‘브리바닙’의 글로벌 임상시험을 중단하고 대신 중국의 신생 제약사 ‘자이랩’에 기술권을 판매하기로 했다. 글로벌 임상시험에 통과하려면 기존 제품에 비해 신약의 약효가 뛰어나다는 점을 입증해야 했는데 이 관문을 통과하기가 쉽지 않다는 판단에서 중국 수출길을 택한 것이다.
자이랩은 글로벌 제약사 바이엘의 동일 약효 제품 ‘소라페닙’의 한달 복용 가격이 7,500달러로 고가인데다 중국 보험도 적용받지 못한다는 점을 노려 브리바닙 기술 도입에 적극 나섰다. 당국으로부터 약물 승인을 쉽게 받을 수 있을 것이라는 기대도 라이선스 거래 성사요인 중 하나다. 중국 당국은 상대적으로 뒤처진 제약업을 발전시키기 위해 자국 제약사의 신약 승인 조건을 해외 기준보다 낮게 적용하는 반면 해외 의약품들은 미국 식품의약국(FDA) 승인요건 외에 추가 실험을 요구하고 있다고 WSJ는 지적했다.
중국 제약업체 시후안은 유럽에서 부작용 때문에 사용이 중단된 발작 치료제 ‘시네파지드’의 기술을 도입한 후 매출 신기록을 내기도 했다. 스페인과 프랑스 등에서는 혈관 부작용 때문에 2000년 이전에 이미 판매가 중단됐지만 시후안은 이 제품의 라이선스를 도입해 2010년 중국에서 가장 많이 팔리는 약품 중 하나로 키웠다.
WSJ는 “자이랩 같은 중국 신생 제약사들은 장기간의 임상시험이라는 장벽을 피하려는 해외 제약사들의 연구성과를 적극적으로 도입하는 전략을 펴고 있다”면서 “하지만 이 같은 중국 제약사의 영업방식으로 중국은 상대적으로 질이 떨어지는 의약품의 덤핑 판매처로 전락할 수 있다”고 꼬집었다.
/베이징=홍병문특파원 hbm@sed.co.kr
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >