제이엘케이(322510)는 두개내출혈 검출 인공지능(AI) 솔루션인 ‘JLK-ICH’가 미국 식품의약국(FDA)으로부터 시판전허가(510k)를 받았다고 6일 밝혔다.
이로써 제이엘케이는 총 5개의 FDA 인허가를 확보하게 됐다. 뇌졸중 솔루션으로는 네 번째 FDA 승인이다. 제이엘케이 관계자는 “이번 인허가는 미국 FDA의 별도 보완 요구 없이 단번에 승인받았다”며 “그동안 다수 해외 인허가 진행으로 제이엘케이의 자체 인허가 역량이 인정받고 있다는 의미”라고 설명했다.
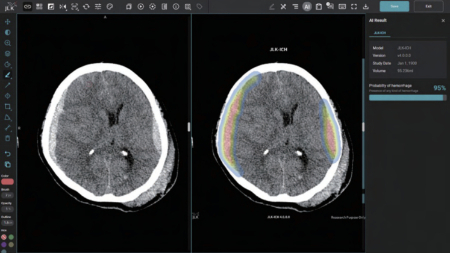
JLK-ICH는 환자의 뇌 컴퓨터단층촬영(CT) 영상을 분석해 뇌출혈 영역을 검출하는 AI 솔루션이다. 뇌졸중 의심환자가 응급실에 도착하면 가장 먼저 뇌 CT를 촬영해 뇌출혈 여부를 확인하는데 이때 JLK-ICH가 함께 쓰일 수 있다. 제이엘케이는 기존에 FDA 승인을 획득한 뇌졸중 분야 AI 솔루션과 이를 연동하면 전주기에 걸친 뇌졸중 진단과 치료 결정에서 시너지를 낼 수 있을 것이라 기대하고 있다.
특히 뇌출혈은 혈관이 막히는 뇌경색 대비 중증도가 높아 치료까지 걸리는 시간을 단축하는 것이 환자 예후 개선에 필수적이다. JLK-ICH는 임상 연구에서 발생 특징이 다른 5개 뇌출혈 유형에 대해 편차 없는 높은 검출 성능을 입증한 만큼 골든타임 확보에 큰 역할을 할 것으로 기대된다.
제이엘케이는 연내 미국 FDA에 6개 추가 인허가를, 일본 의약품·의료기기관리청(PMDA)에 8개 인허가를 신청한다.김동민 제이엘케이 대표는 “보완사항 없이 단번에 승인을 마친 이번 FDA 획득으로 제이엘케이가 자체적으로 구축한 인허가 역량의 우수성을 입증한 만큼 남은 인허가와 현지 보험수가 획득에 주력해 성공적인 해외 진출 성과를 가져오겠다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >










 jpark@sedaily.com
jpark@sedaily.com






































