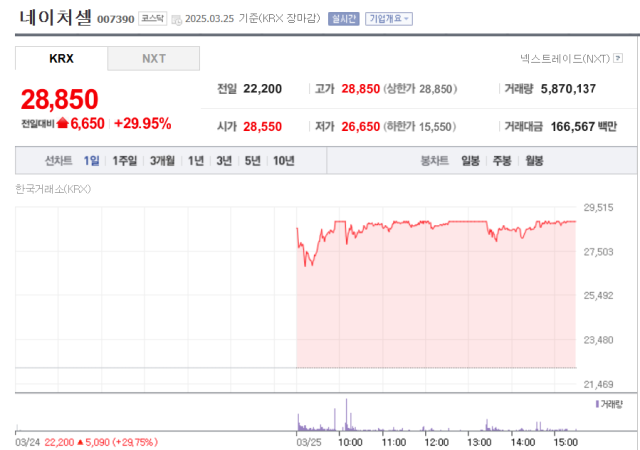
네이처셀(007390)이 미국 식품의약국(FDA)으로부터 퇴행성관절염 세포유전자 치료제 ‘조인트스템’에 대해 혁신적 치료제(Breakthrough Therapy) 지정을 받았다는 소식에 이틀 연속 상한가를 기록했다.
25일 네이처셀은 전 거래일 대비 29.95%(6650원) 오른 2만 8850원에 거래를 마쳤다. 전날에도 상한가로 장을 마감한 데 이어 투자자들의 매수세가 이어진 모습이다.
네이처셀은 지난 21일 장 마감 후 조인트스템이 FDA로부터 혁신치료제로 지정됐다고 발표했다. 조인트스템은 환자의 자가 지방에서 유래한 중간엽 줄기세포를 활용한 세포치료제로, 무릎 관절강에 국소 주사해 연골 재생을 유도하고 통증을 줄이며 관절 기능을 개선하는 효과가 있다는 설명이다. 특히 그 효과가 최소 3년간 지속될 수 있다는 점이 강조된다.
FDA의 혁신치료제 지정은 중대한 질환에 대해 기존 치료법보다 현저히 뛰어난 개선 가능성이 있는 신약 후보에 부여된다. 지정 시 임상 설계 단계부터 FDA와 긴밀히 협의하며 신속한 개발과 허가 심사를 받을 수 있어 신약 개발 속도를 크게 앞당길 수 있다.
다만 조인트스템은 아직 최종 허가까지 넘어야 할 임상 유효성 입증과 안전성 확보 등 관문이 남아 있다. 실제로 조인트스템은 국내에서 임상 3상을 완료했지만 2023년 4월 식품의약품안전처로부터 품목허가를 반려 당했다. 당시 조인트스템 투여군은 대조군 대비 통증 지수(VAS)와 무릎골관절염 증상지수(WOMAC)에서 통계적으로 유의한 개선을 보였으나, 임상적 유의성이 부족하다는 이유로 허가를 받지 못했다. 향후 미국 내 임상 3상 결과와 FDA의 허가 여부에 따라 상용화 가능성과 시장 평가는 달라질 수 있다는 지적도 나온다.
네이처셀 관계자는 “조인트스템은 국내 임상 3상 결과와 더불어 장기 추적 관찰을 통해 효과의 지속성과 안전성을 확인한 바 있다”며 “이번 FDA 혁신치료제 지정은 글로벌 임상 및 허가 과정에서 긍정적인 신호로 작용할 수 있을 것으로 기대하고 있으며, 향후 미국 임상과 허가 절차도 신중하게 준비해 나갈 계획”이라고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 haena07@sedaily.com
haena07@sedaily.com