국내 제약업계에서 자사 복제약에 대한 허가 신청이 소나기처럼 급증하고 있다. 정부가 복제약 허가 규제를 높이려 하자 그 이전에 앞당겨 제품을 내놓으려 안간힘을 쓰는 중이다.
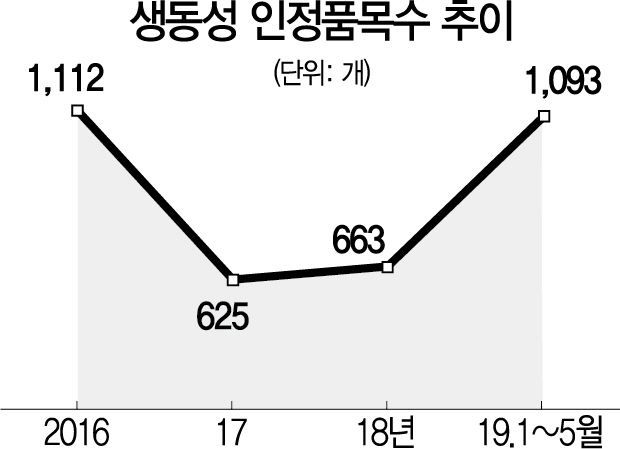
21일 식품의약품안전처에 따르면 지난해 생동성 인정 품목은 총 663개였던 반면 올해 들어선 지난 5월31일까지 무려 1,093개에 이르렀다. 생동성 인정품목수는 2012년 587개이던 것이 이듬해부터 2016년도까지 이상 급증(연간 1,078~1,215개)하다가 2017년부터 반토막 수준으로 감소했었다. 올해 들어 현재와 같은 추세라면 과거 이상 급증기의 수준을 훨씬 넘어설 가능성이 있다.
더구나 실제 출시되는 복제약 종류는 생동성 인정품목수보다 훨씬 많을 것으로 추정된다. 생동성인정품목수에는 해당 시험을 면제 받거나 이화학적 동등성 시험을 통해 허가를 받은 품목들이 빠져 있기 대문이다. 예를 들어 A의약품이 5mg짜리 제재에 대해서만 생동성 시험을 진행한 뒤 해당 품목에 이어 10mg, 20mg짜리 제재도 함께 허가신청을 받아 통과했다면 생동성 인정 품목은 1개인데 비해 시중에 나오는 허가 복제약 수는 3개가 된다.
식약처가 복제약 난립을 막으려고 지난 2월 생동성 시험에 대한 제한을 예고한데 따른 여파로 분석된다. 해당 제한조치는 공동 생동 품목 수를 원제조사 1개와 위탁제조사 3개로 제한하는 이른바 ‘1+3’ 방식을 골자로 하고 있는데 관련 규정이 개정되면 1년간의 유예기간을 거친 뒤 시행된다.
해당 제도 시행 3년 뒤엔 공동생동 및 위탁생동이 폐지될 것으로 전망된다. 1개 복제약에 1개의 생동성 시험자료를 내야 허가를 받을 수 있게 된다는 뜻이다. 공동·위탁 생동이란 복수의 제약사가 함께 비용을 분담해 생동성 시험을 위탁해 실시하는 방식이다. 그동안 공동·위탁 생동에 대한 참여 기업수 제한이 없었기 때문에 영세 중소 복제약 제조사들이 애용해왔다. 복제약의 제조 및 판매를 허가 받으려면 해당 복제약이 원본약의 효과와 안전성을 동일하게 확보했다는 것을 입증하는 생동성 시험을 거쳐야 하는 데 영세업체는 자금과 연구인력 부족으로 인해 단독으로 생동을 진행하기 어려웠기 때문이다. 그 결과 제약사들이 독자 신약을 개발하기 보다는 원본약을 복제한 뒤 공동·위탁생동으로 쉽게 돈을 벌려고 하고 이로 인해 복제약 시장이 난립해 기업들은 영세성을 면치 못하는 악순환이 반복돼 왔다.
식약처가 규제의 고삐를 죈 것은 이 같은 폐단을 해소하려는 측면이 있지만 제약사들이 준비기간을 가질 수 있도록 유예 기간 등을 두기로 했다. 공동생동 폐지 등이 이뤄질 경우 제약사가 부담해야 할 비용이 약 341억원(추정치)에 이를 정도로 만만치 않아 기업들로 하여금 준비할 시간을 갖도록 한 것이다. 하지만 제약사들이 규제 시행 이전에 공동·위탁 생동을 앞당겨 진행하면서 규제 효과가 반감되는 게 아니냐는 우려도 나오고 있다. /이지성기자 engine@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 newsroom@sedaily.com
newsroom@sedaily.com






































