“코로나19 바이러스는 모든 사람들이 면역을 형성하기 전까지 사라지지 않을 것입니다. 노바백스는 SK바이오사이언스(302440)와 함께 한국뿐 아니라 전 세계 소외국에까지 백신을 공급하는 데 기여하겠습니다.”
최근 전 세계적으로 변이 바이러스가 확산하는 가운데 노바백스 백신의 역할에 대한 기대가 커지고 있다. 노바백스가 SK바이오사이언스 등 다른 기업으로의 기술이전을 통한 공급 확대에 적극적이기 때문에 코로나19 백신 물량 확보에 숨통을 트이게 할 것으로 보인다. 특히 SK바이오사이언스는 국내 백신 수급량을 자체적으로 조절할 수 있도록 계약을 체결한 만큼 오는 11월 전 국민 백신 접종 이후 부스터샷은 물론 집단면역 지속을 위한 추가 접종에도 중요한 역할을 할 것으로 기대된다.
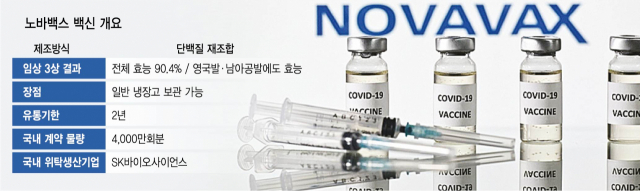
스탠리 어크 노바백스 최고경영자(CEO)는 서울경제와 진행한 서면 인터뷰에서 노바백스 백신의 편의성을 강조했다. 그는 “노바백스 백신은 보관이 용이하기 때문에 초저온 보관을 위한 콜드체인 시스템이 잘 갖춰지지 않은 일부 국가에서 접근성을 높일 수 있다”며 “전 세계적 백신 수급 불균형을 해소할 수 있을 것”이라고 강조했다. 실제 노바백스 백신은 2~8도에서 보관할 수 있을 뿐 아니라 유효기간도 2년에 달한다. 화이자 백신처럼 초저온 유통 시스템을 별도로 구축할 필요가 없어 훨씬 광범위한 지역에서 접종이 가능하다.
어크 CEO는 노바백스 백신의 안전성과 효능에 강한 자신감을 내비쳤다. 그는 “노바백스 백신의 플랫폼은 항원을 광범위하게 중화할 수 있어 다양한 범주의 변이에 대응이 가능하다”며 며 “안전한 플랫폼과 안정성 덕분에 궁극적으로 광범위한 지역에 백신을 공급하는 데 기여할 것”이라고 말했다. 실제 의료계에서는 노바백스 백신의 강점으로 이미 시장에서 상용화된 합성 항원 플랫폼을 활용해 안전성이 입증됐다는 점을 꼽는다. 합성 항원 백신은 면역반응을 일으키는 항원의 단백질 일부만 뽑아 유전자재조합 기술을 이용해 합성하는 방식으로 코로나19 백신뿐 아니라 다른 여러 백신에서 이미 안전성이 입증됐다. 전 세계적으로 백신 접종이 시작된 후 제기된 혈전증 등 다양한 안전성 문제에서 비교적 자유로울 수 있다는 뜻이다. 효능 역시 화이자 등 기존 백신들에 비해 뒤지지 않는다. 노바백스는 지난달 미국과 멕시코에서 2만 9,960명을 대상으로 진행한 임상 3상 시험에서도 90.4%의 예방 효능을 확인했다고 밝혔다. 변이 바이러스 8종에 대해서도 93.2%의 효능을 나타냈다는 게 회사 측의 설명이다. 화이자·모더나 백신에 비해서는 효능이 다소 낮지만 임상 시험이 변이 바이러스가 유행하는 와중에 진행됐기 때문에 전 세계 과학계는 노바백스의 임상 결과를 ‘경이적’이라며 환영하는 분위기다.
특히 노바백스 백신은 SK바이오사이언스가 생산을 맡은 만큼 국내 집단면역 체계 구축에 끼치는 영향도 크다. SK바이오사이언스는 일본 다케다, 인도 세럼 등과 함께 노바백스가 기술이전 계약을 체결한 3개 기업 중 하나다. SK바이오사이언스는 노바백스 백신을 위탁개발생산(CDMO)해 전 세계에 공급하고 한국에 공급하는 물량은 기술이전을 통해 자체 개발할 계획이다. 어크 CEO는 SK바이오사이언스에 대해 “안전하고 효과적인 백신을 (전 세계에) 공급하려는 노바백스의 긴박함을 공유하고 있다”며 “SK바이오사이언스 등 CDMO 기업과 긴밀한 협력을 지속해 코백스 퍼실리티를 포함한 다양한 국가에서 사용 가능한 백신을 생산할 계획”이라고 말했다. 그는 이어 “SK바이오사이언스의 지역 내 생산은 분산된 백신 공급 시스템을 효율화하는 데 기여할 것”이라며 기대감을 표출했다.
하지만 리보핵산(mRNA) 백신으로 이미 3억 회가량의 접종이 이뤄진 상황에서 출시가 계속 미뤄지는 데 대한 우려도 제기된다. 긍정적인 임상 결과를 내놓았지만 화이자·모더나 백신이 충분히 공급되고 있는 만큼 미국 식품의약국(FDA)의 긴급 사용 승인이 쉽지 않을 것이라는 전망이다. 이런 이유로 노바백스는 9월 말까지 미국에 긴급 사용 승인을 요청하지 않고 정식 허가 절차를 밟을 것으로 보인다.
다만 어크 CEO는 임상 3상 결과 발표 당시 “노바백스 백신이 미국이 아닌 다른 국가에서 첫 승인이 이뤄질 수 있다”고 밝힌 바 있다. 영국·유럽연합(EU)·인도·한국 등이 후보로 거론된다. 국내 보건 당국 역시 이르면 3분기 말인 9월께 허가 절차가 진행할 수 있다는 의견을 내놓았다. 손영래 중앙사고수습본부 사회전략반장은 5일 진행된 기자단 대상 브리핑에서 “노바백스 백신은 4,000만 회분 중 2,000만 회분이 3분기에 도입될 예정이었으나 현재 도입 이전 허가 과정이 늦어지고 있다”며 “조만간 미국 FDA에 허가를 신청할 것으로 예상되며 국내에서는 승인 신청이 들어와야 허가가 돼 도입을 논의할 수 있을 것”이라고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >











 wise@sedaily.com
wise@sedaily.com






































