식품의약품안전처는 장애인과 환자의 이동 편의성을 높이기 위해 수동식 휠체어에 부착하는 동력 보조장치를 국내에서 처음 의료기기로 허가했다고 8일 밝혔다. 휠체어 동력 보조장치는 수동식 휠체어를 동력 보조 휠체어나 전동 휠체어처럼 작동할 수 있도록 전환하는 전기 장치다.
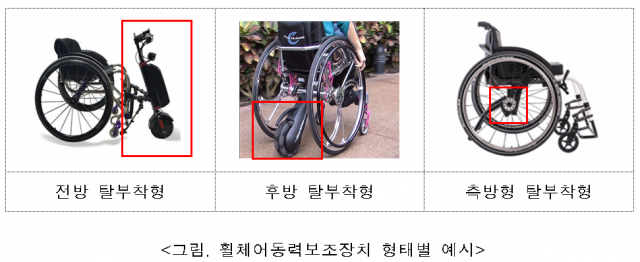
이 제품은 알에스케어서비스가 제조 품목으로 허가 신청한 장치(제품명 무브온)로, 전방 탈부착형 방식이다. 식약처는 휠체어 동력 보조장치의 안전성과 성능, 위험관리, 사용 시 주의사항을 면밀히 검토해 허가했다. 수동 휠체어와 결합하는 제품 특성을 고려해 브레이크 성능, 운전 특성, 피로강도(내구성), 결합부위 충격 등 사용자 안전과 제품 성능을 심사했다. 속도 제한 등 안전성 확보가 적절히 됐는지를 검토하고, 사용자에게 제품과 관련한 안전 정보가 충분히 제공되고 있는지도 확인했다.
식약처는 “이번 제품허가는 법령에 품목분류가 없는 상황에서 적극 행정으로 품목 신설부터 허가까지 해냈다는 점에서 의의가 있다”고 평가했다. 식약처는 휠체어 동력 보조장치 제품화를 위해 규제 개선, 가이드라인 마련, 기술문서 심사기관 교육 등을 통해 다방면으로 지원해왔다. 2019년 2월 휠체어 동력 보조장치를 규제 샌드박스 대상으로 지정하고 새로운 품목을 신설했다. 또 허가·심사 가이드라인을 제정해 제품의 개발·출시를 지원했다. 올해 2월에는 기술문서 심사기관 7개소에서 심사 시 검토해야 하는 주요 사항에 대해 교육했다.
식약처는 이번 품목허가로 수동 휠체어를 사용하는 장애인과 환자의 이동 편의성이 증진될 것으로 기대하고 있다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 haena07@sedaily.com
haena07@sedaily.com







































