신약개발기업 카이노스메드(284620)가 자체 개발 중인 파킨슨병 치료제의 긍정적인 2상 임상 결과를 발표하며 20일 투자자들의 집중적인 관심을 받았다.
카이노스메드는 이날 오전 11시 10분 현재 전 거래일 대비 28.9% 오른 4935원에 거래 중이다. 장 초반 급등세를 보이더니 매수세가 몰리면서 낙폭을 키웠다. 거래량은 이미 300만 주를 넘기며 올해 들어 최고 수준까지 치솟았다. 파킨슨병 치료후보물질 'KM-819'의 2상 임상 시험에서 안전성을 확인했다는 소식이 전해지자 성공 기대감이 반영되며 매수세가 몰린 것으로 풀이된다.
카이노스메드는 이날 오전 미국에서 진행 중인 파킨슨병 치료제 'KM-819' 임상 2상 시험의 첫 단계에서 용량별 부작용이 없음을 확인하고 다음 단계를 진행한다고 밝혔다.
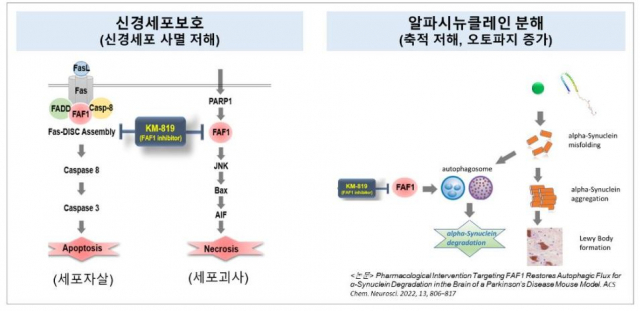
KM-819는 세포의 사멸을 촉진하는 단백질 'FAF1'을 저해하는 기전의 신약후보물질이다. 카이노스메드는 지난해 11월 미국식품의약국(FDA)의 승인을 받고 다계통위축증과 파킨슨병 등에 관한 치료 효능 및 안전성을 평가하는 임상 2상을 시작했다.
해당 임상은 두 부분으로 구성된다. 건강한 노인 18명을 대상으로 시험약 여러 용량을 투입해 사람에게 안전하게 투여할 수 있는 최대용량을 선정하는 첫 단계를 거쳐 파킨슨병 환자 24명에게 시험약 여러 용량을 투입하는 방식이다. 이날 발표에 따르면 건강한 사람에게 'KM-819'를 최대 800mg까지 투여해도 부작용이 나타나지 않아 파킨슨병 환자에게 600mg까지 투여할 수 있게 됐다.
난치질환인 파킨슨병은 아직 근본적인 치료제가 없다. 시장조사기관 MARC에 따르면 세계 파킨슨병 시장은 2020년 약 8조 원에서 2026년 11조 원에 달할 것으로 예상된다.
이재문 카이노스메드 사장은 "다음 시험이 성공하면 안전한 최적의 용량을 결정해 임상 2상의 주요 평가항목인 유효성을 확인할 계획"이라며 "KM-819의 기술이전을 포함해 글로벌 탑 제약사들과 공동개발 업무협력 체계 구축을 위한 협의도 긴밀하게 논의 중"이라고 말했다.
◇Why 바이오 코너는 증시에서 주목받는 바이오 기업들의 이슈를 전달하는 연재물입니다. 주가나 거래량 등에서 특징을 보인 제약·바이오 기업에 대해 시장이 주목한 이유를 살펴보고, 해당 이슈에 대해 해설하고 전망합니다. 특히 해당 기업 측 의견도 충실히 반영해 중심잡힌 정보를 투자자와 제약·바이오 산업 관계자들에게 전달합니다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >











 realglasses@sedaily.com
realglasses@sedaily.com






































