대웅제약이 세계 최초 신약(First-in-class)으로 개발 중인 특발성 폐섬유증 치료제 ‘베르시포로신’이 임상 2상에서 안전성을 검증 받았다.
대웅제약은 3월 개최한 1차 독립적 데이터 모니터링 위원회(Independent Data Monitoring Committee·IDMC) 회의에 이어 26일 개최한 2차 회의에서도 임상 지속을 권고 받았다고 29일 밝혔다. IDMC는 임상에서 환자의 안전과 약물 효능 등을 모니터링하는 전문가 그룹으로 해당 물질의 안정성과 과학적 타당성이 확보됐다는 평가다. IDMC는 내년 초 예정된 3차 회의에서 베르시포로신 임상 2상의 안전성을 최종 점검할 예정이다.
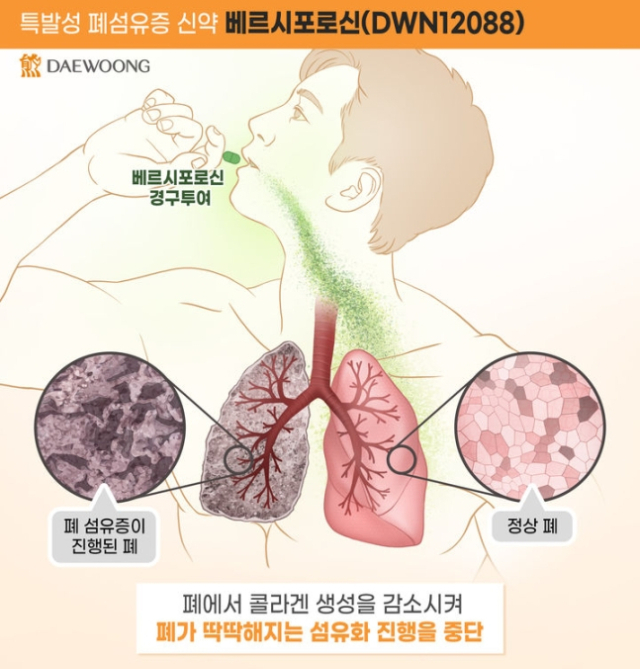
특발성 폐섬유증은 폐에 콜라겐이 비정상적으로 축적돼 폐 기능이 상실되는 난치병이다. 진단 후 5년 생존율이 40%에 불과할 정도로 예후가 좋지 않은 치명적 질환이다. 대웅제약은 베르시포로신이 콜라겐 합성을 직접 억제하는 만큼 기존 치료제와 차별화된 안전성과 효능을 보여줄 것으로 기대된다고 전했다.
임상 2상은 2025년 이내 완료할 계획이다. 40세 이상 특발성 폐섬유증 환자를 대상으로 진행되며 현재 허가된 치료제를 복용 중이거나 중단한 환자들이 참여하고 있다. 이창재 대웅제약 대표는 “이번 IDMC 권고는 베르시포로신의 원활한 개발에 있어 안전성을 입증한 중요한 이정표”라고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >










 1min9@sedaily.com
1min9@sedaily.com







































