제약·바이오 기업들이 희귀의약품 시장을 신약 개발의 새로운 기회로 삼고 있다. 희귀질환 치료제는 시장 규모는 작지만 높은 수익성과 시장 독점권 부여 등의 혜택으로 주목 받고 있다. 지난해 국내에서 미국 식품의약국(FDA) 희귀의약품 지정을 받은 사례는 전년보다 6건 늘어 역대 최대치를 기록했다.
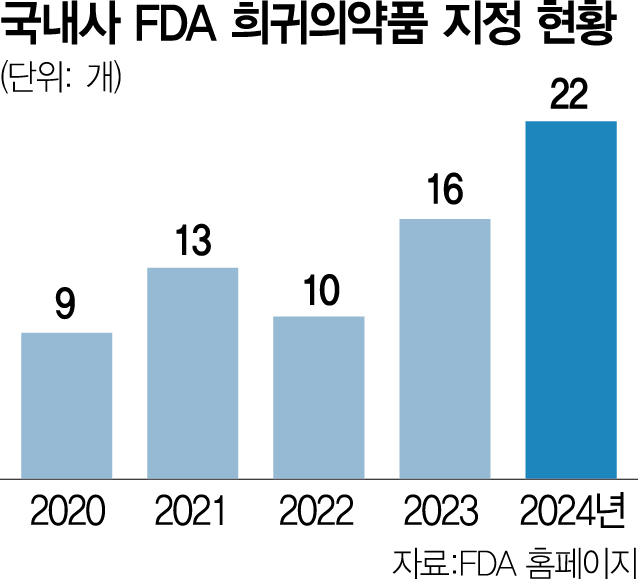
2일 업계에 따르면 지난해 미국 FDA 희귀의약품 지정(ODD) 품목 리스트에 기재된 국내 제약·바이오사 의약품은 22개다. 2023년 16개 보다 6개 늘었다. ODD 품목 리스트 기재 의약품은 2020년 9개, 2021년 13개, 2022년 10개 등을 기록하고 있다. 지난해는 보령 혈관면역아세포림프종(BR-101801) 치료제를 시작으로 알지노믹스의 간세포암 치료제(RZ-001), 네오이뮨텍의 췌장암 치료제(NT-I7), 스파크바이오의 특발성폐섬유증 치료제(SBP-401), 에스엔바이오의 췌장암 치료제(SNB-101) 등이 이름을 올렸다.
희귀질환 치료제는 기존 치료제가 없거나 부족한 상황에서 개발되면 높은 경제적 잠재력을 지닌다는 장점이 있다. 개발 기간은 길지만 개발 이후 독점적으로 시장을 점유할 수 있어 강력한 시장 지배력을 확보할 수 있다. 각국은 희귀질환 치료제에 인센티브를 제공하며 개발을 독려하고 있다. 미국은 허가 심사비용 면제, 시판 허가 후 7년간 미국 내 시장독점권 등을 제공한다.
다만 국내 업체들이 희귀의약품 지정을 받더라도 최종 개발까지 도달하는 사례는 아직 드물다. 미국에서도 FDA에서 희귀의약품 지정을 받은 의약품 가운데 6분의 1가량 만이 최종 품목 허가나 조건부 허가를 받는 것으로 알려졌다. 국내 업체 중에서는 GC녹십자(006280)의 뇌실 내 투여방식의 중증형 헌터증후군 치료제인 헌터라제 ICV가 FDA 희귀의약품 지정을 받은 후 일본과 러시아에서 품목허가를 획득했다.
국내시장 역시 마찬가지다. 식품의약품안전처 의약품 품목허가 현황에 따르면 지난해 품목허가 희귀의약품 16개 가운데 국내 제품은 찾을 수 없다. 한독, GC녹십자, JW중외제약 등이 받은 품목허가는 국내 판권을 획득한 도입 상품인 경우다. 개발 단계에서 희귀의약품에 지정된 의약품 53개도 개발을 완주한 경우는 드물다. 희귀질환의 특성상 임상시험 참여 환자가 제한적이며 효과와 안전성을 입증하기 어렵기 때문이다. 그럼에도 일반 의약품과 비슷한 수준의 비용과 시간이 소요돼 개발 단계에서 경제적인 부담이 크다.
한독의 크리오피린 관련 주기적 증후군 후보물질 HL2351은 임상 2상까지 승인받았지만 환자 모집에 어려움을 겪고 개발을 중단했다. 제약업계 관계자는 “희귀의약품은 의약품이 아닌 질환에 대해 지정되므로 약의 가치를 입증해야 하는 큰 과제가 남아있다”며 “국내는 아직까지 희귀질환 파이프라인도 적고 정부지원도 미미하므로 개발 단계에서 세제혜택과 재정적인 지원이 반드시 필요하다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >










 haena07@sedaily.com
haena07@sedaily.com






































