글로벌 1위 바이오의약품 위탁생산(CMO) 전문기업으로 올라선 삼성바이오로직스(207940)가 잇따라 각국 의약품 규제당국의 바이오의약품 제조인증을 획득하며 독보적인 위상을 이어가고 있다.
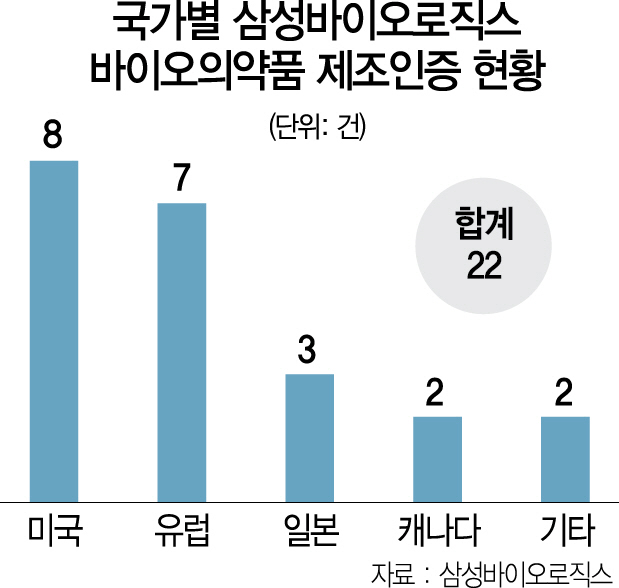
삼성바이오로직스는 올 들어 2건의 글로벌 바이오의약품 제조인증을 획득해 누적 인증건수 22건을 기록했다고 13일 밝혔다. 앞서 1월 일본 의약품의료기기종합기구(PMDA)로부터 인증을 획득했고 3월에는 캐나다 연방보건부(HC)로부터 추가 인증을 받았다. 이는 지난 2017년 일본 PMDA와 2018년 캐나다 HC로부터 각각 첫 승인을 받은 후 두 번째다.
삼성바이오는 지난 2015년 미국 식품의약국(FDA)으로부터 첫 제조인증을 획득하며 글로벌 CMO 전문기업으로 첫발을 내디뎠다. 평균 2개월에 1건꼴로 바이오의약품 위탁생산(CMO) 후발주자로 시장에 진출했다는 점을 감안하면 독보적인 경쟁력을 입증했다는 설명이다. 지난 2017년에는 연간 18만ℓ의 바이오의약품을 생산할 수 있는 제3공장까지 준공하며 연간 생산량 36만ℓ를 확보한 글로벌 1위 바이오의약품 CMO로 올라섰다.
각국 의약품 규제기관의 제조인증 건수가 늘면서 삼성바이오의 전담 인력도 급증했다. 2015년 70명이었던 제조인증 대응 인력은 현재 330여명으로 늘었다. 2016년에는 신속하고 체계적인 글로벌 제조인증 획득을 위해 디지털 기반의 시스템까지 구축했다. 반도체 설비투자를 통해 구축한 역량을 바이오의약품 생산설비로 확대한 것이 주효했다는 평가다.
세계에서 가장 문턱이 높기로 유명한 미국 FDA의 ‘워닝레터’(Warning Letter)를 2011년 창립 이후 한 건도 수령하지 않았다는 점도 삼성바이오의 경쟁력이다. FDA 워닝레터는 미국 의약품 품질관리 기준인 ‘cGMP’ 기준을 충족시키지 못했다는 일종의 경고장이다. FDA는 지난해에만 주요 글로벌 바이오제약기업을 대상으로 127곳의 워닝레터를 발송했다. 인도 기업이 60건으로 가장 많았고 중국(24건), 한국(9건)이 뒤를 이었다.
삼성바이오로직스 관계자는 “회사가 단기간에 22건에 달하는 글로벌 제조승인을 획득할 수 있던 것은 우수한 인력과 철저한 품질관리 시스템 덕분”이라며 “FDA가 미국 진출을 희망하는 기업을 실사한 뒤 중대한 결함을 지적하는 ‘워닝레터’가 전무하다는 점도 삼성바이오로직스의 글로벌 경쟁력을 입증하는 대표적인 사례”라고 말했다.
/이지성기자 engine@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >