한국 한국 제약·바이오 산업의 대표 주자 중 하나인 셀트리온(068270)과 LG화학이 세계 최대 의약품 시장인 미국에서 의미있는 도전을 한다. 두 회사의 이번 미국 임상 3상 시험이 성공할 경우 K-바이오의 글로벌 위상도 한 단계 올라갈 것으로 예상된다.
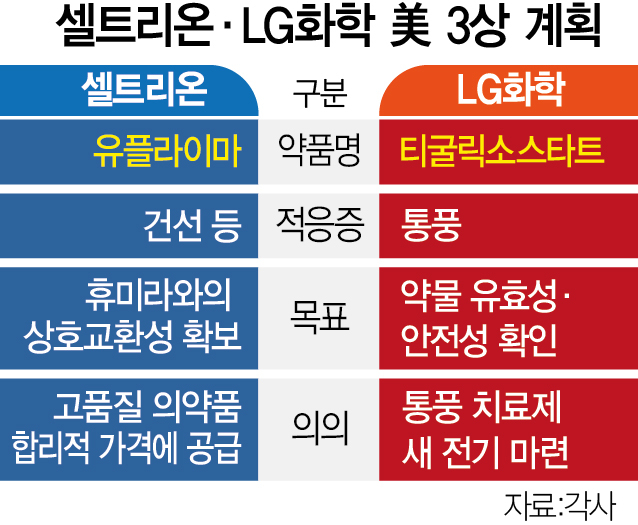
LG화학은 1일 미국 식품의약국(FDA)에 자체개발 통풍신약 ‘티굴릭소스타트’ 임상 3상 시험계획을 신청했다고 밝혔다. LG화학이 자체적으로 미국을 포함한 글로벌 지역에서 신약 임상 3상에 나서는 건 이번이 처음이다.
이번 임상은 고요산혈증 동반 성인 통풍 환자 350명을 대상으로 복용 6개월 째의 약물 유효성과 안전성을 평가한다. LG화학은 이번 3상 시험에 성공해 2027년 미국 FDA로부터 1차 치료제로 품목허가를 받고 2028년부터 글로벌 판매에 나선다는 목표다.
티굴릭소스타트는 통풍의 원인인 요산을 생성하는 효소 ‘잔틴 옥시다제(XO)’의 발현을 억제하는 1일 1회 경구 복용 통풍 치료제다. 미국 임상 2상 시험 결과 신속하고 강력한 요산 강하 효과와 안전성을 확인했다.
글로벌 시장조사기관 코히어런트 마켓 인사이트 자료에 따르면 세계 통풍 치료제 시장은 고령화와 비만인구 증가 추세에 따라 2019년 3조 원에서 2027년에는 5조 원 규모로 확대될 것으로 예상된다. 현재 전세계 통풍 진단 환자는 3500만 명이며 이 중 미국에만 1000만 명이 있다.
손지웅 LG화학 생명과학사업본부장은 “이번 글로벌 3상을 성공하고 상업화 준비도 선제적으로 해 세계 통풍 치료제 시장에서 새로운 전기를 마련하겠다”고 말했다.
셀트리온도 지난달 29일(현지시간) FDA에 자가면역질환 치료제 ‘CT-P17(성분명 아달리무맙·제품명 유플라이마)과 오리지널 의약품 ‘휴미라’ 간 상호교환성 확보를 위한 글로벌 3상 임상시험계획(IND)을 제출했다고 1일 밝혔다.
셀트리온은 판상 건선 환자 366명을 대상으로 글로벌 3상 임상시험을 진행할 계획이다. 유플라이마와 휴미라를 다회 교차 투약한 그룹과 휴미라만 투여한 그룹 간 약동학·유효성·안전성 등을 비교 검증한다. 셀트리온은 이번 임상을 통해 미국에서 휴미라의 인터체인저블 바이오시밀러 지위를 확보해 글로벌 시장에서 점유율을 확대한다는 계획이다.
휴미라는 지난해 세계에서 약 27조 원의 매출을 올리며 글로벌 의약품 전체 판매 순위 2위를 기록했다. 이 중 미국에서만 약 22조 원 규모가 팔렸다.
셀트리온 관계자는 “미국에서 인터체인저블 바이오시밀러 지위를 확보하면 약국에서 약사의 처방으로 오리지널 의약품을 대체할 수 있다"면서 "고품질의 바이오의약품을 합리적인 가격에 공급할 수 있도록 판매 준비 작업에도 최선을 다하겠다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >