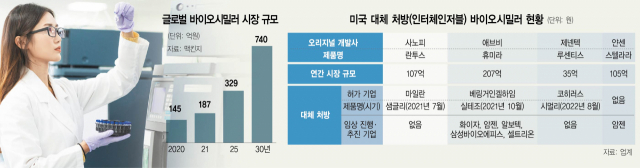
바이오시밀러 시장의 주도권 경쟁이 치열해지면서 ‘인터체인저블(대체가능)' 허가가 차별화된 경쟁력의 기준으로 주목받고 있다. 인터체인저블이란 미국과 유럽 등에서 사용되고 있는 제도로 의사가 처방한 오리지널 약을 약사가 의사의 의견을 따로 구하지 않고 같은 효능을 가진 복제약으로 바꿔 환자에게 처방하는 것이다. 오리지널 약과 성능이나 부작용 등이 비슷해야 하기 때문에 추가적인 임상과 까다로운 입증을 통과해야만 인터체인저블 허가를 받을 수 있다. 허가 과정은 쉽지 않지만 허가를 받으면 프리미엄 복제약으로 평가를 받을 뿐만 아니라 약국에서 훨씬 자유롭게 사용될 수 있는 장점이 있다.
5일 업계에 따르면 내년 1월 특허가 만료되는 미국 제약사 애브비의 자가면역질환 치료제 ‘휴미라’의 바이오시밀러에 대한 인터체이저블 허가를 얻기 위한 임상이 봇물을 이루고 있다.
베링거인겔하임이 지난해 8월 미국 식품의약국(FDA)으로부터 자체 개발 중인 휴미라 바이오시밀러에 대해 인터체인저블 허가를 받은 데 이어 삼성바이오에피스, 셀트리온(068270), 화이자, 알보텍, 암젠 등 국내외 업계가 인터체인저블 허가를 얻기 위한 임상에 나서고 있다. 휴미라는 지난해 27조 원의 판매고를 올리며 올해까지 10년째 '글로벌 매출 1위' 블록버스터 지위를 유지하고 있는 약이다.
바이오시밀러 업계가 휴미라에 대한 인터체인저블 허가를 받으려는 이유는 경쟁력 차별화를 위해서다. 인터체인저블 바이오시밀러 허가를 받으려면 추가 임상에만 수십~수백억 원이 더 투입되지만 향후 시장 점유율과 마케팅 면에서 필수적이라는 게 업계의 시각이다. 바이오업계 관계자는 "눈치를 보고 있던 바이오시밀러 개발사들이 베링거인겔하임의 인터체인처블 바이오시밀러 승인 발표 이후 곧바로 추가 임상에 착수했다"며 "모든 바이오시밀러 업계가 기본으로 허가를 받으려는 분위기라 승인을 받지 못하면 성능이 뒤처진다는 평가가 나올 것"이라고 말했다.
휴미라로 촉발된 인터체인처블 경쟁이 다른 약으로 확산하고 있다. 앞서 2021년 7월 마일란이 당뇨병 치료제 '란투스'의 바이오시밀러에 대해, 올 8월에는 코히러스가 '루센티스'의 바이오시밀러에 대해 인터체인저블 승인을 받았다. 이에 자극받은 암젠은 지난달 휴미라에 이어 '스텔라라'의 바이오시밀러도 인터체인저블 품목 허가를 추진한다고 발표했다. 스텔라라는 물질특허가 미국에서 2023년 9월, 유럽에서 2024년 7월 만료되는 연 14조 원 규모의 블록버스터 의약품이다. 삼성바이오에피스, 셀트리온, 알보텍 등 주요 바이오 기업들은 임상 3상 단계에 진입해 있다.
특히 미국 정부가 인플레이션 감축법(IRA)을 시행해 오리지널 의약품에 대한 약가 인하 압박이 커질 것으로 보여 인터체인저블의 활용성이 더 커질 것이란 전망이 나온다. 실제 IRA 시행에 따라 미국 공공의료보험기관(CMS)은 2026년부터 장기간 독점 의약품에 대한 강제 약가 협상을 할 수 있게 됐다. 통상 바이오시밀러는 오리지널 보다 20~30% 낮은 가격에 판매하기 때문에 돼 오리지널 약가도 비슷한 수준으로 하락한다. 매킨지에 따르면 향후 10년 이내에 특허 만료 예정인 블록버스터 바이오의약품은 55개 이상이다.
한국바이오협회 관계자는 "인플레이션 감축법과 향후 블록버스터 의약품 특허 만료로 바이오시밀러 경쟁이 심화할 전망"이라며 "다양한 경쟁력 가운데 인터체인저블 바이오시밀러가 핵심 시장 전략이자 협상 조건이 될 것"이라고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >