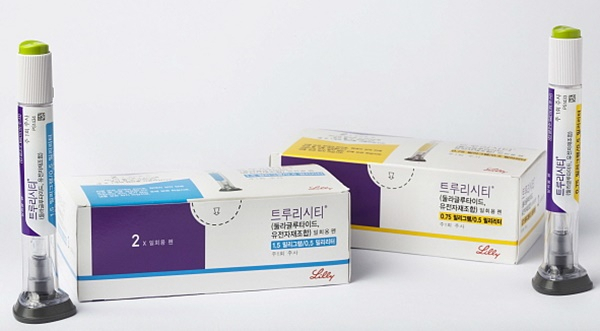
중국 국가약품감독관리국(NMPA)이 미국 일라이릴리의 당뇨병치료제인 트루리시티에 대한 바이오시밀러 허가 신청을 접수했다. 해당 의약품에 대한 세계 최초 허가 신청 사례로 당뇨 및 비만치료제 바이오시밀러에 대한 경쟁이 치열해질 것으로 전망된다.
3일 한국바이오협회에 따르면 중국 보안 바이오텍은 28일 NMPA이 제2형 당뇨병 성인 혈당 조절 약물인 둘라글루타이드 주사제에 대한 허가 신청(BLA)을 공식 접수했다고 발표했다. 회사는 올해 4월에 NMPA에 허가 신청을 했으며 이번에 공식 접수된 것이다.
이번 접수는 미국 일라이릴리의 당뇨병치료제인 트루리시티에 대한 세계 최초의 바이오시밀러 허가 신청 사례다. 둘라글루타이드는 일주일에 한 번 투여되는 지속성 글루카곤 유사 펩타이드-1(GLP-1) 수용체 작용제다. 지난해 트루리시티의 전 세계 매출은 약 71억 3000만 달러였다.
중국에서는 다수의 기업들이 GLP-1 바이오시밀러 개발을 추진하고 있다. 세계적인 시장분석기업인 클래리베이트 자료에 따르면 중국에서 세마글루타이드에 대한 바이오시밀러에만 허가단계 1건, 임상3상 6개, 임상2상 4개, 임상1상 11개가 개발되고 있다. 중국에서는 지난해 화둥 메디슨이 개발한 노보 노디스크의 삭센다(리라글루타이드) 바이오시밀러 또한 최초로 승인된 바 있다.
인도 제약회사들도 당뇨 및 비만치료제 복제약을 경쟁적으로 개발하고 있다. 인도 바이오콘은 올해 3월 리라글루타이드 주사제의 첫 번째 제네릭을 영국에서 허가받았다. 당뇨병 및 체중 감량에 대한 GLP-1의 영국 시장은 4억 2500만 달러다.
바이오콘은 미국과 유럽 규제 당국에도 리라글루타이드에 대한 허가신청서를 제출한 상태다. 회사는 또다른 15개의 펩타이드 제형을 개발하고 있으며 이 중 한두 가지 약물이 올해 추가로 허가될 것으로 예상하고 있다. 이 외에도 선 파마슈티컬 인더스트리, 닥터레디즈, 씨플라 등 인도 제약회사들이 당뇨 및 비만치료제 복제약을 경쟁적으로 개발하고 있다.
한국바이오협회는 “블록버스터 의약품인 오젬픽과 위고비에 대한 세마글루타이드 특허가 2026년부터 국가별로 만료되기 시작하면 중국 및 인도를 비롯한 많은 기업들의 복제약 경쟁은 더 치열해질 것으로 예상된다”고 전했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >










 1min9@sedaily.com
1min9@sedaily.com