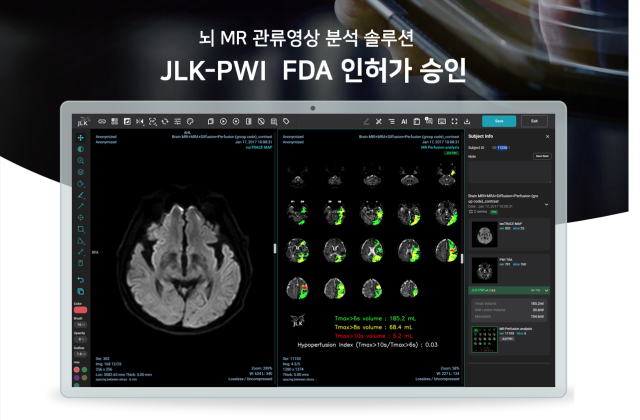
제이엘케이(322510)는 인공지능(AI) 관류(혈액·체액 흐름) 영상 뇌졸중 솔루션인 ‘JLK-PWI’가 미국 식품의약국(FDA)에서 시판 전 승인(510K)를 받았다고 6일 밝혔다. 510K는 FDA 의료기기 인허가의 한 종류다. 기존 의료기기의 성능과 동등성을 비교 평가해 보다 빠르게 시장 진입을 할 수 있도록 허용하는 제도다.
JLK-PWI는 뇌 자기공명(MR) 관류영상을 자동으로 분석해 회복 가능성이 낮은 뇌경색 중심 영역과 혈액 공급이 저하된 뇌관류 저하 영역에 대한 정량적인 지표를 제공하는 솔루션이다. 초급성기 뇌경색 환자의 혈전제거술을 포함해 응급 수술 여부를 신속하게 결정할 수 있어 급성 뇌경색 환자의 예후 개선에 도움을 준다.
이번 승인은 제이엘케이의 4번째 FDA 승인이다. 앞서 제이엘케이는 전립선암 솔루션 ‘MEDIHUB Prostate’와 뇌졸중 솔루션 ‘JLK-LVO’, ‘JLK-CTP’을 승인 받았다. 제이엘케이는 연내 3개의 추가 뇌졸중 솔루션을 FDA에 신청하고 현지 보험수가 획득에 주력한다는 방침이다.
김동민 제이엘케이 대표는 “이번 FDA 승인으로 미국 시장에 제이엘케이 MRI 솔루션의 우수성을 널리 알릴 수 있게 됐다” 며 “CT, MRI 모두를 커버하는 세계 최초 전주기 뇌졸중 풀 솔루션 보유기업의 입지를 미국 현지에서도 굳건히 구축해 나가겠다”고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >








 mindmin@sedaily.com
mindmin@sedaily.com