시지바이오는 자체 개발한 척추 임플란트 ‘노보맥스 퓨전’이 유럽연합(EU) 의료기기 규정 ‘CE MDR’ 인증을 획득했다고 26일 밝혔다. 국내 기업이 척추 임플란트 분야에서 최고 등급(Class III)으로 MDR 승인을 받은 것은 처음이다.
이번 인증은 EU가 지정한 공식 글로벌 인증기관인 BSI(British Standards Institution)의 심사를 통해 발급됐다. MDR은 2021년 5월부터 시행된 유럽의 새로운 의료기기 규정으로, 기존 제도인 'MDD'보다 임상 평가, 안전성과 효과 검증, 품질 관리 기준 등이 강화됐다. Class III 등급은 인체에 장기간 삽입되거나 생명 유지와 직접 관련된 제품에 적용되는 최고 등급이다.
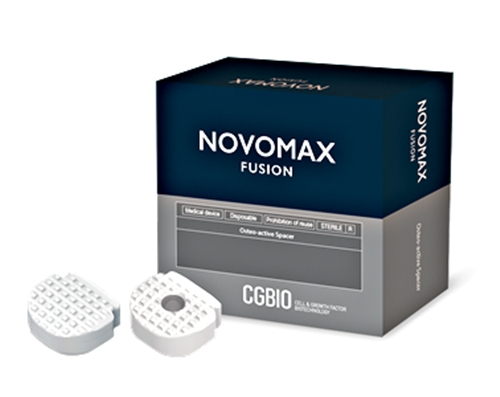
노보맥스 퓨전은 목뼈 사이 디스크가 손상됐을 때 그 자리에 삽입해 척추를 고정하고 유합을 돕는 경추유합술용 케이지다. 전방에 접근해 척추뼈 C3~T1 구간에 이식되며, 노보맥스 퓨전은 손상된 디스크를 대신해 뼈 사이를 지탱하고 붙여주는 지지대 역할을 한다.
이 제품에는 시지바이오가 독자적으로 개발한 생체활성 유리세라믹 신소재 ‘BGS-7’이 적용됐다. 기존 티타늄 케이지는 강도와 생체적합성이 우수하지만 단단한 성질로 인해 침강 현상이 발생할 수 있고, 피크(PEEK) 케이지는 뼈와 유사한 강도로 침강 위험은 적지만 뼈와 직접 결합하지 못해 추가 골이식재가 필요한 한계가 있다.
반면 노보맥스 퓨전은 뼈와 직접 유합되는 BGS-7 소재 특성으로 체내 삽입 후 표면에서 뼈가 바로 자라 붙으며, 설계된 접촉 면적도 넓어 안정적으로 지지할 수 있다. 이로써 별도 골이식재 없이도 안정적 유합이 가능하다. 연구 결과 PEEK 케이지 대비 뼈와의 결합 강도가 약 15배 높게 나타나기도 했다.
유현승 시지바이오 대표는 “노보시스 등 주요 제품군의 유럽 CE MDR 인증도 준비 중이며, 올해 하반기 완공되는 시지바이오 ‘노보 팩토리(Novo Factory)’를 통해 늘어날 공급 수요에 대응할 것”이라며 “일본에 이어 유럽, 호주 등 선진 시장을 필두로 글로벌 척추 임플란트 시장 진출을 추진할 것”이라고 말했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 mindmin@sedaily.com
mindmin@sedaily.com







































