‘알파고의 아버지’ 데미스 허사비스 구글 딥마인드 최고경영자(CEO)를 비롯해 신약 개발용 인공지능(AI) 개발자들이 노벨화학상 공동 수상자로 선정됐다. 기초과학 중심의 노벨위원회가 응용과학인 AI에 손을 들어주며 노벨물리학상에 이어 화학상까지 내리 석권했다.
스웨덴 왕립과학원 노벨위원회는 9일(현지 시간) AI를 활용해 단백질 구조를 예측하고 설계한 공로로 허사비스 CEO와 존 점퍼 딥마인드 수석연구원, 데이비드 베이커 미국 워싱턴대 생화학과 교수를 올해 노벨화학상 수상자로 선정했다고 발표했다. 노벨위원회는 “베이커 교수는 완전히 새로운 종류의 단백질을 만드는, 불가능에 가까운 업적을 달성했다”며 “허사비스 CEO와 점퍼 연구원은 단백질의 복잡한 구조를 예측하는 50년 된 문제를 해결하는 AI 모델을 개발했다”고 설명했다.
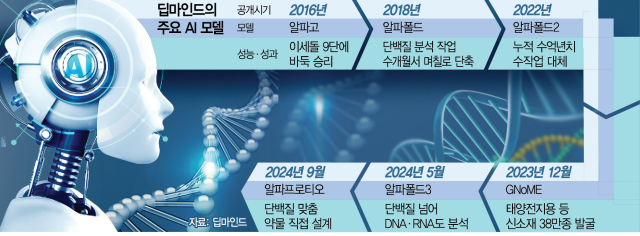
허사비스 CEO가 이끄는 딥마인드 연구진은 2016년 이세돌 9단을 이긴 바둑 AI 알파고를 개발해 전 세계에 충격을 준 데 이어 단백질의 구조를 분석하고 다양한 약물과의 상호작용을 예측할 수 있는 AI 모델 ‘알파폴드’ 시리즈를 개발했다. 알파폴드는 몸속에서 질병을 일으키는 단백질을 효과적으로 치료할 수 있는 최적의 약물을 빠르게 찾아준다. 이를 통해 연구자들의 수작업으로 수개월 이상 걸리던 단백질 분석을 며칠 만에 처리한다.
공동 수상한 베이커 교수는 알파폴드의 경쟁 모델로 평가받는 ‘로제타폴드’를 2021년 공개했다. 알파폴드에서 나아가 단백질 구조에 맞는 약물을 직접 설계까지 해주는 AI를 개발해 당시 국제 학술지 사이언스에서 ‘최고의 연구 성과’로 선정됐다.
전날 ‘AI 대부’ 존 홉필드 미국 프린스턴대 명예교수와 제프리 힌턴 캐나다 토론토대 명예교수가 노벨물리학상을 받은 데 이어 화학상까지 AI 개발자들에게 주어지자 과학계는 충격적이라는 반응을 보이고 있다. 조정효 서울대 물리교육과 교수는 “최근 AI의 막대한 영향력을 고려한 수상자 선정으로 해석된다”고 말했다.
1년만에 수억년치 단백질 분석…암·유전병 정복 머지 않았다
9일(현지 시간) 올해 노벨화학상 수상자로 선정된 데미스 허사비스 구글 딥마인드 최고경영자(CEO)와 존 점퍼 수석연구원, 데이비드 베이커 워싱턴대 생화학과 교수는 AI 신약 개발에 있어 블록버스터급 혁신을 촉발했다는 평가를 받는 인물들이다. ‘알파고의 아버지’로 불리는 허사비스와 점퍼가 개발한 인공지능(AI) ‘알파폴드2’는 2022년 공개돼 1년여간 수억 개의 단백질 구조를 분석했다. 이는 전 세계 연구자들이 동시에 매달려 실험하더라도 수억 년이 걸리는 분량이다. 베이커 교수가 만든 경쟁 AI인 ‘로제타폴드’는 여기서 더 나아가 최적의 약물을 설계해주는 성능을 세계 최초로 선보이며 학계를 또 한번 흔들었다.
국내 AI 신약 개발 기업 갤럭스의 석차옥 대표(서울대 화학과 교수)는 “자연과학 분야에서 그동안 해결하지 못한 문제들이 AI 덕분에 점점 풀리고 있다”며 “이번 수상자들은 단백질 구조 문제를 AI를 통해 어떻게 해결할 수 있는지 선례를 남겼다는 점에서 높이 평가받는다”고 말했다. 베이커 교수의 제자이자 로제타폴드 공동 연구자인 백민경 서울대 생명과학부 교수는 “베이커 교수는 단백질이 원하는 기능을 할 수 있도록 (물질을) 설계하는 연구를 처음 시작했다”며 “이 분야가 언제 빛을 볼까 생각하며 연구해왔는데 예상보다 상당히 일찍 인정받은 것 같아 고무적”이라고 전했다. 딥마인드는 이날 입장문을 통해 “이번 노벨상 선정은 AI와 계산생물학을 비롯해 자연과학 자체의 기념비적인 업적”이라고 평가했다. 베이커 교수도 “허사비스와 점퍼의 AI 방법론을 단백질 설계에 접목해 힘과 정확성을 크게 키울 수 있었다”고 소감을 밝혔다.
기초과학 제친 AI알파·로제타폴드
알파폴더3에서 생체분자까지 파악
알파폴더3에서 생체분자까지 파악
알파폴드와 로제타폴드는 신약 개발의 필수 절차인 단백질 분석이나 설계를 대신해주는 AI 모델이다. 수개월에서 길면 수년까지 걸리던 작업을 며칠 단위로 단축해준다. 올 5월 선보인 ‘알파폴드3’는 단백질뿐 아니라 유전물질인 디옥시리보핵산(DNA), 리보핵산(RNA) 등 다양한 생체분자까지 분석하는 수준으로 성능이 향상됐다. DNA·RNA가 손상돼 생기는 암과 다양한 유전병 정복까지 AI가 해결사로 나설 수 있게 된 것이다.
여기에 지난달 공개된 알파프로티오는 특정 단백질을 여러 후보 약물들과 일일이 대조하는 것을 넘어 아예 단백질 구조에 적합한 약물의 구조를 설계하는 모델로 한층 진보된 성능을 보여줬다. 박태용 갤럭스 부사장은 “알파폴드도 선구적이었는데 알파프로티오가 나오면서 하늘과 땅 차이의 발전을 보인 것”이라며 “신약 발굴에 혁신을 가져올 수 있다”고 평가했다.
알파폴드의 가파른 진화 배경에는 베이커 교수 연구팀이 개발한 강력한 라이벌 로제타폴드가 있다. 로제타폴드는 2021년 사이언스의 ‘최고의 연구 성과’로 선정된 데 이어 알파폴드3에 앞서 올해 초 DNA·RNA까지 분석하는 ‘로제타폴드 올아톰’을 공개했다. 2022년 공개한 단백질 설계 AI ‘로제타폴드 디퓨전’ 역시 알파프로티오보다 한발 빨랐다.
두 모델의 등장을 계기로 AI 신약 개발 시장도 본격적으로 열렸다. 엔비디아는 기업용 AI 신약 개발 플랫폼 ‘바이오니모’를 통해 저분자 설계를 포함해 단백질 구조 예측 서비스를 제공하고 있다. 마이크로소프트(MS)의 오픈소스(개방형) 모델 ‘에보디프’ 역시 일부 단백질 설계를 지원한다. 빅파마 일라이릴리와 노바티스는 연초 허사비스 CEO가 이끄는 신약 개발사 아이소모픽랩스와 최대 17억 달러(약 2조 3000억 원), 12억 달러(약 1조 6000억 원) 규모의 약물 개발 협력 계약을 맺었다. 삼정KPMG에 따르면 전 세계 AI 신약 개발 시장 규모는 지난해 2조 3000억 원에서 2030년 28조 원으로 급성장할 것으로 전망된다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >













 sookim@sedaily.com
sookim@sedaily.com









































